Arista™ AH Particules Hémostatiques résorbables est indiqué dans les interventions chirurgicales (sauf ophtalmiques) en tant que dispositif hémostatique d’appoint pour aider lorsque le contrôle des saignements capillaires, veineux et artériolaires par pression, ligature et autres procédures conventionnelles s’avère inefficace ou peu pratique. Dispositif médical de classe III MDR (EU) 2017/745, CE 2797, Fabricant : Davol Inc. Pour un bon usage se référer à la notice d'utilisation. Edition avril 2023
Veuillez noter que certains produits, services ou caractéristiques pourraient ne pas être disponibles dans votre région. Veuillez consulter votre représentant BD local.
INDICATIONS
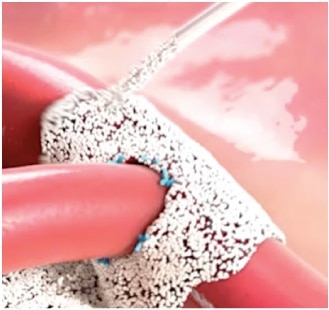
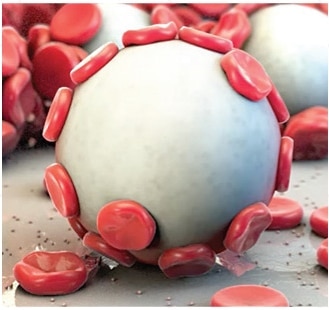
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions ophtalmiques) en tant que dispositif hémostatique d’appoint pour aider au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
CONTRE-INDICATIONS
- ARISTA™ AH ne doit pas être injecté ni appliqué dans les vaisseaux sanguins, sous peine d’entraîner un risque d’embolie pouvant causer la mort.
AVERTISSEMENTS
- L’innocuité et l’efficacité d’Arista™ AH n’ont pas été testées dans le cadre d’essais cliniques chez les enfants et les femmes enceintes et/ou qui allaitent. Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une activité inférieure des amylases ; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
- Une fois l’hémostase atteinte, l’excès d’Arista™ AH doit être éliminé du site d’application par irrigation et aspiration, surtout si le produit est utilisé près des foramens osseux et des zones à proximité des os, de la moelle épinière, du nerf optique et/ou du chiasma optique. Arista™ AH gonfle pour atteindre son volume maximal dès son contact avec le sang ou tout autre liquide. Tout volume d’Arista™ AH sec et blanc doit être éliminé. La possibilité d’interférence du produit avec une fonction normale et/ou d’apparition d’une nécrose de compression des tissus voisins due au gonflement est réduite par l’élimination de l’excédent de matériel sec.
- Ce dispositif est à usage unique. La réutilisation, le retraitement, la restérilisation et/ou le reconditionnement peuvent compromettre les principales caractéristiques de la conception ou du matériau, essentielles aux performances générales du dispositif, et conduire à un dysfonctionnement de ce dernier, pouvant ainsi blesser le patient. La réutilisation, le retraitement, la restérilisation ou le reconditionnement du dispositif peuvent également générer un risque de contamination de ce dernier et/ou entraîner une infection ou une infection croisée chez le patient, notamment la transmission de maladies infectieuses d’un patient à un autre. La contamination du dispositif pourrait entraîner des lésions, des maladies ou le décès du patient ou de l’utilisateur final.
- Arista™ AH n’a pas été conçu pour se substituer à une technique chirurgicale méticuleuse ni à l’application adéquate de ligatures ou d’autres méthodes conventionnelles d’hémostase.
- L’innocuité et l’efficacité du produit dans le cadre d’interventions ophtalmiques n’ont pas été déterminées.
- Arista™ AH ne doit pas servir au contrôle des saignements après un accouchement ou des ménorragies.
- L’utilisation d’Arista™ AH en présence d’une infection ou sur une zone corporelle contaminée doit se faire avec précaution. Une nouvelle chirurgie pourrait être nécessaire en présence de signes d’infection ou de développement d’un abcès au site d’application d’Arista™ AH afin de permettre le drainage.
- Éliminer le dispositif après utilisation. Ce produit pourrait présenter un risque biologique. La manipulation et la mise au rebut doivent s’effectuer conformément aux pratiques médicales acceptées et aux réglementations locales, nationales et fédérales en vigueur.
PRÉCAUTIONS
- Seuls les médecins possédant une qualification aux techniques chirurgicales appropriées peuvent utiliser ce dispositif.
- L’innocuité et l’efficacité du produit dans le cadre d’interventions neurochirurgicales n’ont pas été déterminées par des études cliniques randomisées.
- Quand Arista™ AH est utilisé conjointement avec des circuits de récupération de sang autologue, il convient de suivre attentivement les directives de la section Administration concernant l’exécution d’une filtration appropriée et d’un lavage cellulaire.
- Arista™ AH a été conçu pour être utilisé à l’état sec. Un contact préalable à l’application avec du sérum physiologique ou une solution antibiotique pour atteindre l’hémostase entraînera une perte du potentiel hémostatique.
- Arista™ AH est livré stérile et ne peut pas être restérilisé. Tout contenant d’Arista™ AH ouvert et inutilisé doit être éliminé.
- N’appliquez pas une quantité d’Arista™ AH excédant 50 g chez un patient diabétique ; il a été calculé qu’une quantité excédant 50 g pouvait avoir un impact sur la charge glycémique.
- L’utilisation d’Arista™ AH n’est pas recommandée pour le traitement primaire des troubles de la coagulation.
- Dans le cadre d’une intervention urologique, Arista™ AH ne doit pas être laissé dans le bassinet ni dans l’uretère afin d’éviter tout foyer potentiel de formation de calculs.
- Aucun essai n’a été exécuté pour vérifier l’utilisation d’Arista™ AH sur les surfaces osseuses sur lesquelles des dispositifs prothétiques doivent être fixés avec un adhésif ; une telle utilisation n’est donc pas recommandée.
RÉACTIONS INDÉSIRABLES
Au cours d’un essai clinique prospectif randomisé à contrôle concurrent, un total de 288 patients randomisés ont reçu soit l’ARISTA™ AH, soit le contrôle (consistant en une compresse de gélatine avec ou sans thrombine). Les événements indésirables les plus fréquents sont les suivants : douleurs liées à la chirurgie, anémie, nausée et valeurs d’analyses de laboratoire hors des plages normales. La liste exhaustive suivante présente les événements indésirables signalés chez plus de 5 % des patients traités avec Arista™ AH. La liste des évènements indésirables du groupe de contrôle est présentée à des fins de comparaison. Aucun des événements indésirables survenus n’a été jugé comme étant lié à l’usage d’Arista AH™ par le Comité de surveillance de la sécurité des données.
Reportez-vous aux étiquettes et aux notices du produit pour connaître les indications, les contre-indications, les risques, les avertissements, les précautions et le mode d’emploi.