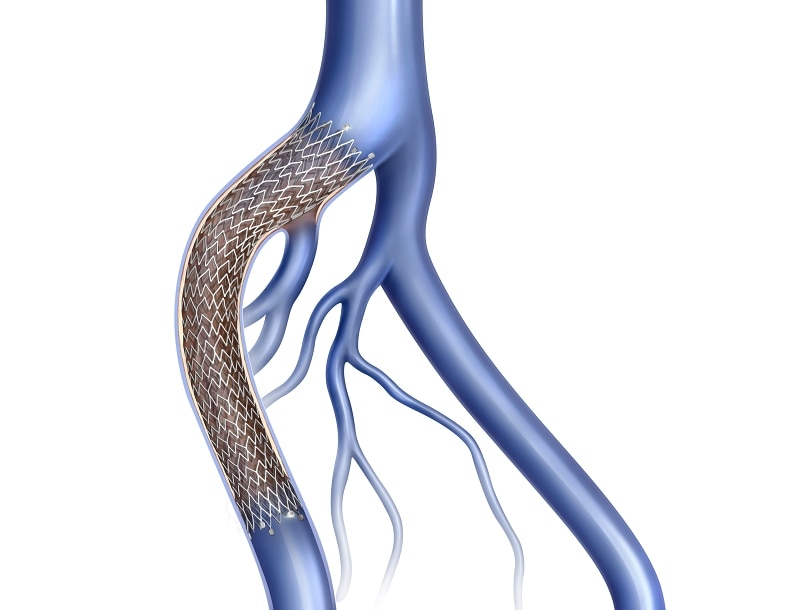
- 静脈専用に開発したナイチノール製自己拡張型ステントにより拡張力と柔軟性のバランスを実現しています。
- Tri-axial deliveryシステム(3層構造のデリバリシステム)により術者の正確なステント留置をサポートします。
- 独自のフレアエンド(3 mm)のステント形状により血管壁への密着性を確保したデザインを採用しました。


Tri-axial deliveryシステム(3層構造のデリバリシステム)の以下の特長は術者のスムースな手技をサポートします。
販売名:VENOVO 静脈ステントシステム
医療機器承認番号:30500BZX00065000
製造販売元:株式会社メディコン
Venovo™ 静脈ステントシステムは、フレアエンドで設計されている静脈ステントです。
販売名:VENOVO 静脈ステントシステム
医療機器承認番号:30500BZX00065000
製造販売元:株式会社メディコン
¹ Dake MD, O’Sullivan G, Shammas NW, et al. Three-year results from the Venovo venous stent study for the treatment of iliac and femoral vein obstruction. Cardiovascular and Interventional Radiology. 2021;44(12):1918-1929.
Venovo™ 静脈ステントシステムは、170 名の患者に対する単群の非無作為化前向き多施設共同臨床試験であるVERNACULAR試験で評価されました。有効性主要評価項目は、手技後12ヶ月時の一次開存(PP)であり、対象血管の再血行再建術(TVR)ならびにDUS測定による血栓性閉塞および狭窄(>50%)の回避と定義されました。Venovo™ 静脈ステントを留置した患者の 12ヶ月後の加重平均後の一次開存率は88.6%で、パフォーマンスゴール(PG)である74%と比較して統計学的有意差が示されました。安全性主要評価項目は、手技後30日時における主要有害事象(MAE)の回避率であり、MAE回避率は93.5%であり、PG 89%と比較して統計学的有意差が示されました。30日間の主要安全性評価時点および36ヶ月経過時点において、CECが判定した有害事象に関連するステントの移動は認められませんでした。
主要な有効性評価項目: 12 ヶ月時の一次開存率
12 ヶ月時の一次開存率: 88.6%
深部静脈血栓症後症候群(PTS):81.7%
非血栓性腸骨静脈病変(NIVL):97.1%
*複数の文献を参照し、有効性 74%(p<0.0001)および安全性 89%(p=0.032)を評価基準(パフォーマンスゴール : PG)として設定し検証しています。。
販売名:VENOVO 静脈ステントシステム
医療機器承認番号:30500BZX00065000
製造販売元:株式会社メディコン
¹ Dake MD, O’Sullivan G, Shammas NW, et al. Three-year results from the Venovo venous stent study for the treatment of iliac and femoral vein obstruction. Cardiovascular and Interventional Radiology. 2021;44(12):1918-1929.
Venovo™ 静脈ステントシステムは、170 名の患者に対する単群の非無作為化前向き多施設共同臨床試験であるVERNACULAR試験で評価されました。有効性主要評価項目は、手技後12ヶ月時の一次開存(PP)であり、対象血管の再血行再建術(TVR)ならびにDUS測定による血栓性閉塞および狭窄(>50%)の回避と定義されました。Venovo™ 静脈ステントを留置した患者の 12 ヶ月後の加重平均後の一次開存率は88.6%で、パフォーマンスゴール(PG)である74%と比較して統計学的有意差が示されました。安全性主要評価項目は、手技後30日時における重大な有害事象(MAE)の回避率とし、結果はMAE回避率は93.5%であり、PG 89%と比較して統計学的有意差が示されました。30日間の主要安全性評価時点および36ヶ月経過時点において、CECが判定した有害事象に関連するステントの移動は認められませんでした。
Kaplan-Meier推定法による 36ヶ月時の一次開存率は、全対象者(N=170)で84.0%、血栓後症候群患者(N=93)で74.8%、非血栓性腸骨静脈病変患者で95.5%でした。副次的評価項目には、急性期における技術的成功率、生活の質(QoL)評価、静脈臨床重症度スコア(VCSS-疼痛スコア)およびステント破断が含まれました。結果は、急性期における技術的成功率は100%でした。(定義:指標手技時の治験責任医師の評価どおり適切な病変範囲を備えた標的へのステント留置の成功)。
TLRは、独立したコアラボにより判定される指標手技後の標的血管における初回の再血行再建術と定義され、36ヶ月時点のTLR回避率は88.1%でした。36ヶ月のフォローアップ時におけるCIVIQ-20の評価は、全対象集団でベースラインからの変化量が-16.8、VCSS疼痛スコアでは-1.8で改善がみられました。36ヶ月フォローアップ時にステントの破損解析を実施し、評価対象となった各ステントの前後方向および側面X線写真は独立したコアラボにおいて分析され、98例の被験者のX線写真においてステント破損の報告はありませんでした。
製品の使用の適応、禁忌、警告、注意事項、予想される合併症、有害事象、および安全性に関する詳細については、取扱説明書をReferencesしてください。