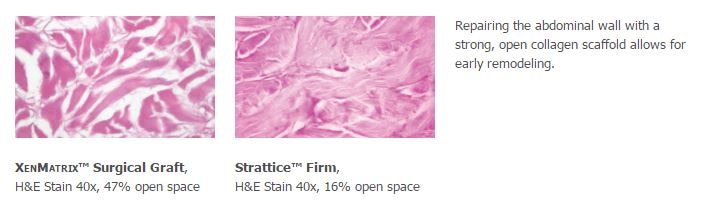
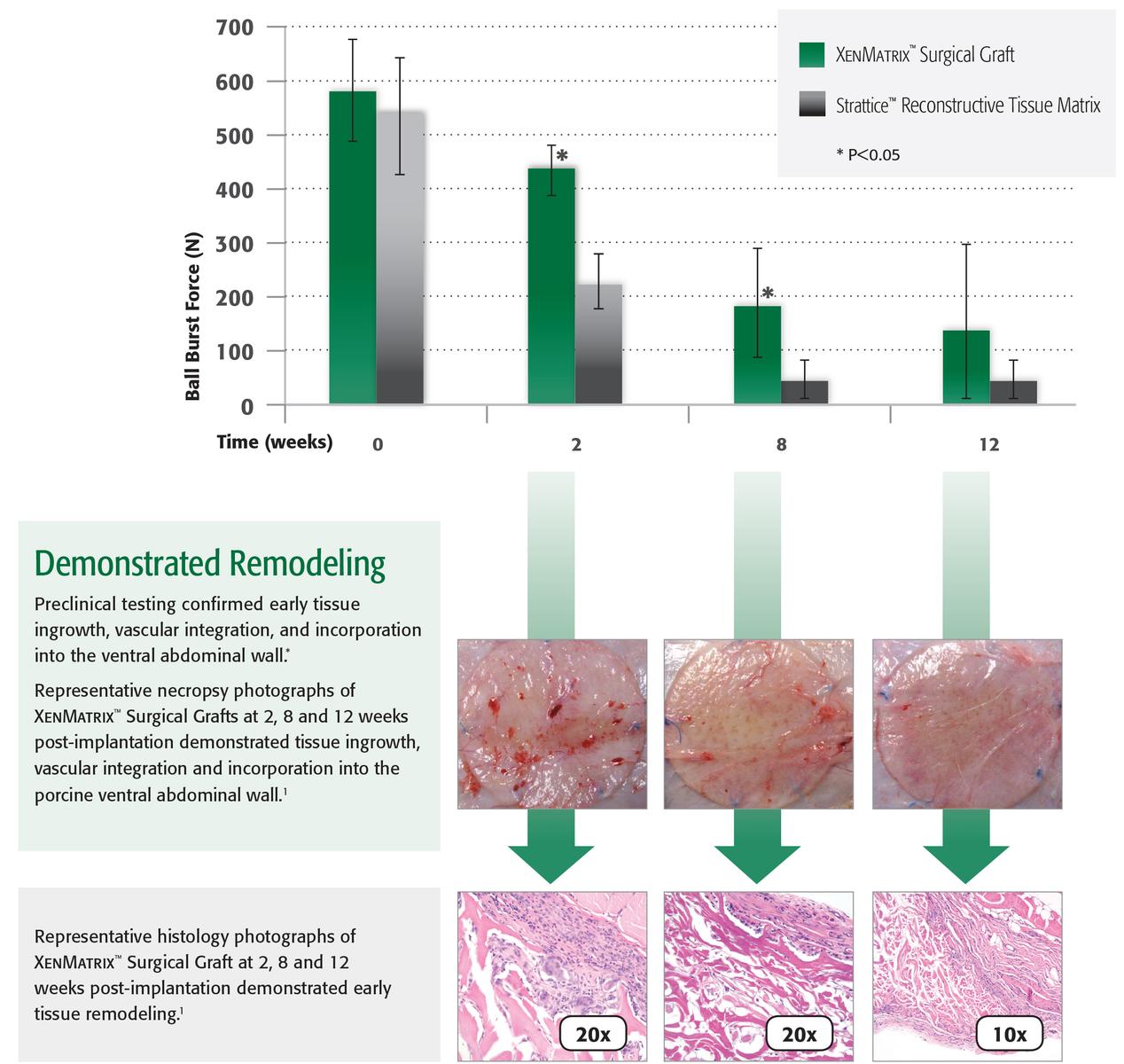
Beachten Sie, dass möglicherweise nicht alle Produkte, Dienstleistu
ngen oder Merkmale von Produkten und Dienstleistungen in Ihrer Region verfügbar sind. Bitte erkundigen Sie sich bei Ihrem BD Vertreter vor Ort.
Referenzen
- Präklinische Daten sind hinterlegt; Ergebnisse entsprechen nicht zwingend der klinischen Leistung.
- Deeken CR, Eliason B, Pichert M, Grant S, Frisella M, Matthews B. Differentiation of Biologic Scaffold Materials Through Physiomechanical, Thermal and Enzymatic Degradation Techniques. Ann Surg 2012. Mar; 255(3):595-604.
Indikationen
XenMatrix™ Surgical Graft ist für die Implantation zur Verstärkung von Weichteildefekten mit Schwachstellen bei Bauch- und Narbenhernien vorgesehen.
Kontraindikationen
- XenMatrix™ Surgical Graft sollte nicht bei Patienten mit bekannter Überempfindlichkeit gegenüber Schweineprodukten verwendet werden.
- Nicht für die Rekonstruktion von kardiovaskulären Defekten.
- Nicht zur Rekonstruktion von Defekten des zentralen Nervensystems oder des peripheren Nervensystems.
- Die Verwendung dieses Produkts für andere als die angegebenen Anwendungen birgt das Potenzial für schwerwiegende Komplikationen.
Warnhinweise
- Dieses Produkt ist nur für den einmaligen Gebrauch bestimmt. Die Wiederverwendung, Wiederaufbereitung, Resterilisation oder Neuverpackung kann die strukturelle Integrität und/oder wesentliche Material- und Konstruktionsmerkmale, die für die Gesamtleistung des Produkts entscheidend sind, beeinträchtigen und zu einem Versagen des Produkts führen, was zu Verletzungen des Patienten führen kann. Die Wiederverwendung, Wiederaufbereitung, Resterilisation oder Neuverpackung kann auch das Risiko einer Kontamination des Produkts mit sich bringen und/oder eine Infektion des Patienten oder eine Kreuzinfektion verursachen, einschließlich, aber nicht beschränkt auf die Übertragung von Infektionskrankheiten von einem Patienten auf einen anderen. Eine Kontamination des Produkts kann zu Verletzungen, Krankheiten oder zum Tod des Patienten oder des Endanwenders führen.
- NICHT RESTERILISIEREN
- Prüfen Sie vor der Verwendung sorgfältig die Verpackung und das Produkt, um sicherzustellen, dass keine der beiden Komponenten beschädigt ist und alle Siegel intakt sind. Nicht verwenden, wenn die Verpackung beschädigt oder offen ist oder wenn die Mitte der Temperaturanzeige auf dem Folienbeutel schwarz ist.
- Wenn sich eine Infektion entwickelt, sollte sie aggressiv behandelt werden.
- Eine allergische Reaktion, die nicht mit einer anderen Therapie zusammenhängt, ist ein Hinweis darauf, dass das XenMatrix™ Surgical Graft entfernt werden sollte.
- Nach dem Gebrauch sollten unbenutztes Produkt und die Verpackung als potenzielles Biogefährdungspotenzial behandelt werden. Behandeln und entsorgen Sie es in Übereinstimmung mit der anerkannten medizinischen Praxis und den geltenden lokalen, staatlichen und bundesstaatlichen Gesetzen und Vorschriften.
- Die Sicherheit und Wirksamkeit von XenMatrix™ Surgical Graft bei den folgenden Anwendungen wurde nicht bewertet oder festgestellt: a. Schwangere oder stillende Frauen b. Pädiatrische Anwendung.
Vorsichtsmaßnahmen.
- Bitte lesen Sie vor der Anwendung alle Anweisungen.
- Dieses chirurgische Transplantat sollte nur von Ärzten verwendet werden, die in den entsprechenden chirurgischen Techniken qualifiziert sind.
- Strenge aseptische Techniken sollten befolgt werden.
- Der Chirurg sollte das chirurgische Verfahren und die Leistungsmerkmale des chirurgischen Transplantats genau kennen.
- Platzieren Sie das Transplantat in größtmöglichem Kontakt mit gesundem, gut vaskularisiertem Gewebe, um das Einwachsen von Zellen und den Gewebeumbau zu fördern.
- Wenn Sie die Haut über dem XenMatrix™ Surgical Graft nicht schließen können, stellen Sie sicher, dass das Implantat feucht bleibt. Vermeiden Sie das Austrocknen des Implantats durch "fortgesetzte Saugvorrichtungen", da dies die Leistung des Implantats beeinträchtigen kann.
Unerwünschte Reaktionen
Zu den möglichen Komplikationen gehören unter anderem Allergien, Serome, Infektionen, Entzündungen, Adhäsionen, Fistelbildung, Hämatome und das Wiederauftreten des Gewebedefekts. Bitte lesen Sie die Packungsbeilage des Produkts, um genauere Sicherheitsinformationen und Gebrauchsanweisungen zu erhalten.