*as of January 2024
2Le système d’endoprothèse veineuse Venovo™ a été soumis à l’étude dans le cadre de l’essai clinique international VERNACULAR, une étude prospective multicentrique non randomisée à groupe unique menée sur 170 patients. Le principal critère d’évaluation d’efficacité de l’étude est la perméabilité primaire à 12 mois après l’intervention, définie comme l’absence de revascularisation des vaisseaux cibles (TVR); l’absence d’occlusion par thrombus et de sténose > 50 % mesurée par échographie en duplex (DUS). Les patients qui ont reçu un système d'endoprothèse veineux VENOVO® présentaient un taux de perméabilité primaire (PP) pondéré de 88,3 %, une différence statistique importante par rapport à l’objectif de performance (PG) de 74 % défini dans la littérature. Le critère d’évaluation principal de l’étude en termes de sécurité portait sur l’absence d’événement indésirable sévère (EIS) pendant 30 jours après la procédure de référence. L’absence d’EIS dans 93,5 % des cas démontre une différence statistique importante par rapport à l’objectif de performance de 89 % défini par les documentations. There were no stent migrations associated with CEC-adjudicated events at the 30-day primary safety endpoint or through 36 months. Dake MD, O’Sullivan G, Shammas NW, et al. Three-year results from the Venovo venous stent study for the treatment of iliac and femoral vein obstruction. Cardiovasc Intervent Radiol. 2021;44(12):1918-1929. doi: 10.1007/s00270-021-02975-2
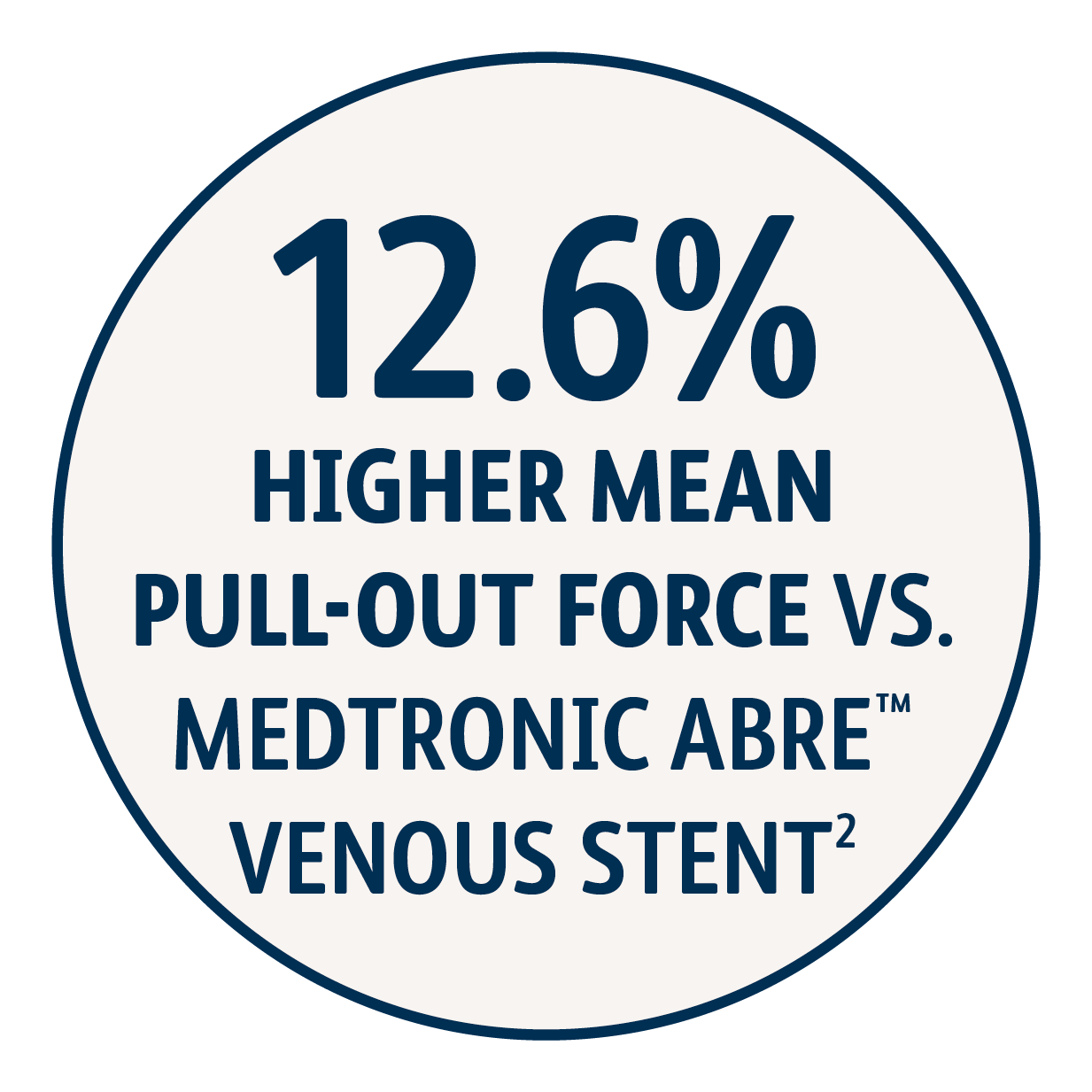
1 Données d’utilisation simulée archivées. BD, Tempe, AZ. Les données peuvent ne pas être prédictives des résultats cliniques réels. Des méthodes d'essai différentes peuvent donner des résultats différents. Tuteur Venovo™ (14 mm x 100 mm, n = 6) et tuteur Medtronic Abre™ (14 mm x 100 mm, n = 6). • La force de traction maximale d’un implant d’une section de tubulure en silicone à un surdimensionnement d'1 mm et à une longueur de chevauchement de 40 mm a été mesurée. Une force de traction supérieure est interprétée comme une résistance à la migration plus élevée. L’endoprothèse Venovo™ a démontré une force de traction moyenne supérieure (0,107 N/mm) par rapport à l’endoprothèse Abre™ de Medtronic (0,095 N/mm).
1 Données d’utilisation simulée archivées. BD, Tempe, AZ. Les données peuvent ne pas être prédictives des résultats cliniques réels. Des méthodes d'essai différentes peuvent donner des résultats différents. Venovo™ Stent (14 mm x 100 mm, N=6), Cook Zilver® Vena™ Stent (14 mm x 100 mm, N=6). • La force de traction maximale d’un implant d’une section de tubulure en silicone à un surdimensionnement d'1 mm et à une longueur de chevauchement de 40 mm a été mesurée. Une force de traction supérieure est interprétée comme une résistance à la migration plus élevée. L’endoprothèse Venovo™ a démontré une force de traction moyenne supérieure (0,107 N/mm) par rapport à l’endoprothèse Abre™ de Medtronic (0,095 N/mm).
BD, le logo BD et Venovo sont des marques commerciales de Becton, Dickinson and Company ou de ses filiales. Toutes les autres marques de commerce appartiennent à leurs propriétaires respectifs. © 2023 BD. Tous droits réservés. Illustrations par Mike Austin © 2023. Becton, Dickinson and Company | www.bd.com | 1 800 321 4254 | 1625 W. 3rd Street Tempe, AZ 85281 É.-U.